
Atommodell
Der Aufbau eines Atoms nach dem Bohrschen Atommodell:

- Atomkern mit Kernladungzahl / Ordnungszahl Z (positiv geladen)
- Elektron (e) auf der ersten Kreisbahn (negativ geladen)
- Radius der Kreisbahn (r)
- Bahngeschwindigkeit (v)
- Anziehungskraft zwischen Atomkern und Elektron (Fc = Coulombkraft)
- Zentrifugalkraft (Fz)
- Zentrifugalkraft (Fz) und Coulombkraft (Fc) müssen im Gleichgewicht sein ===> Fz = Fc
- Coulombkraft (Fc) = (Z * e²) / (4 * Π * ε0 * r²)
- Coulombkraft zwischen zwei Ladungen Q (Fc) = -((Q1 * Q2) / (4 * Π * ε0 * r²))
- Zentrifugalkraft (Fz) = (me * v²) / r
Weitere wichtige Formelzeichen:
- Kreiszahl Pi = 3.14...
- Elementarladung e = 1.602 * 10^-19 As
- Permittivität des Vakuums ε0 = 8.854 * 10^-12 As/Vm
- Ruhemasse Elektron me = 9.1094 * 10^-31 kg
- Ruhemasse Proton mp = 1.6726 * 10^-27 kg
- Impuls p = m * v
Gesamtenergie des Elektrons (Abhängig von seiner Bahn)
- Wges = Wkin + Wpot
- Wkin = (m * v²) / 2 oder p² / (2 * m)
- Wpot = (Ep * p1) / Q
- Potentielle Energie Ep in Joul
Columbsche Potentialtopf
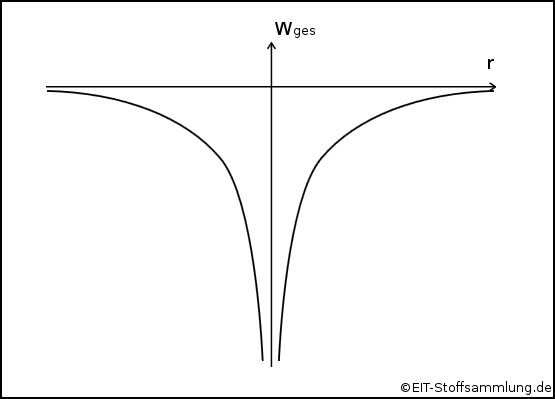
- je weiter die Elektronen vom Atomkern entfernt sind, desto geringer ist ihre Gesamtenergie (Wges)
Elektromagnetische Strahlung
- Energie wird in diskreten Pakte abgegeben (Lichtquanten oder Photonen)
- Energie des Photons (Wp) = h * f oder (h * c0) / λ oder 1240nm eV / λ
- Energie des Photons hängt von der Frequenz (f) ab
- Plancksche Wirkungsquantum (h) = 6.626 * 10^-34 Js
- Frequenz der Strahlung (f) = ΔW / h
- Vakuumlichtgeschwindigkeit (c0) = 2.998 * 10^8 m / s
Bohrsche Postulate
- Elektron darf sich nur auf bestimmten Bahnen strahlungsfrei aufhalten
- Beim Wechsel zwischen den Bahnen wird die Energiedifferenz absorbiert oder emittiert
Wellenlänge
- Wellenlänge der Energiedifferenz (λ) = (1240 nm eV) / ΔW
- Wellenlänge eines Masseteilchens (λm) = h / p oder h / m * v
Elektronenzustände
Bahnwechsel von Elektronen (Zustands Übergänge)
- Wechsel von höher gelegener Bahn zu einer niedrigeren Bahn ===> emission
- Wechsel von einer niedrigeren Bahn zu einer höheren Bahn ===> absorbation
Emission sichtbaren Lichts
- Sichtbares Licht 400 - 700 nm
- blau = 400 nm = 3,1 eV = 0,75 * 10^15 Hz
- grün = 550 nm = 2,26 eV = 0,55 * 10^15 Hz
- rot = 700 nm = 1,77 eV = 0,43 * 10^15 Hz
